Ophtalmologie
Publié le 07 juil 2017Lecture 23 min
Prise en charge de la rétinopathie diabétique - Les points clés du nouveau référentiel SFD/SFO*
Sylvie FELDMAN-BILLARD, Service de médecine interne, CHNO des Quinze-Vingts, Paris
Près d’un million de personnes sont aveugles dans le monde et 4 millions malvoyantes en raison d’une rétinopathie diabétique (RD), cause majeure de cécité et de malvoyance(1). Or, cette complication oculaire et ses conséquences visuelles peuvent être prévenues par le contrôle adapté des facteurs systémiques (glycémie et pression artérielle) et une prise en charge précoce de la RD. En effet, certains patients sont encore asymptomatiques mais leur vision peut être déjà menacée. De plus, les nouvelles techniques d’imagerie non invasives permettent aussi aujourd’hui d’affiner le diagnostic et de faciliter le suivi ophtalmologique des patients diabétiques.
Les modalités de dépistage, de surveillance et le traitement de la RD ont largement évolué ces dernières années. Un nouveau référentiel validé par la Société francophone du diabète (SFD) et la Société française d’ophtalmologie (SFO) a été publié en 2016(2). Établi par un groupe d’experts* représentatifs des différentes professions impliquées dans la prise en charge des complications oculaires du diabète, ses principaux points clés sont détaillés ci-dessous.
Prévalence de la RD : près d’un patient diabétique sur 3 est concerné
Bien que tous les patients diabétiques soient à risque de développer une RD, un certain nombre de facteurs de risque plus spécifiques ont été identifiés (tableau 1). Ainsi, au-delà de la durée du diabète, principal déterminant de la RD, les deux facteurs de risque de la RD sur lesquels il est essentiel d’agir sont le contrôle glycémique et tensionnel. En témoigne la réduction de moitié de la prévalence de la RD et de l’œdème maculaire diabétique (OMD) par une prise en charge optimisée de ces facteurs systémiques.
*Données issues de 35 études de population menées à l’échelon mondial incluant un total de 23 000 patients diabétiques âgés de 20 à 79 ans.
**Pression artérielle > 140/90 mmHg ou patient traité par antihypertenseur. RD : rétinopathie diabétique ; RDP : rétinopathie diabétique proliférante ; OMD : œdème maculaire diabétique
En effet, d’après les résultats des dernières études internationales, la prévalence de la RD est maintenant estimée entre 25 et 30 % alors qu’elle était proche de 50 % il y a une vingtaine d’années(3). Toutefois, par extrapolation de ces données à la population mondiale, près de 100 millions de patients sont aujourd’hui atteints d’une RD dans le monde. La RD proliférante (RDP) a, elle aussi, largement bénéficié de cette meilleure prise en charge avec une réduction de sa prévalence de près des deux tiers chez le patient diabétique de type 1.
Par ailleurs, l’incidence cumulée à 5 ans de la RD est de l’ordre de 30 %, celles de la RDP et de l’OMD sont proches de 3 % chacune. Néanmoins, 6 à 8 % des patients diabétiques de type 2 présentent déjà une RD à la découverte de leur diabète.
La RD : une atteinte microvasculaire précédée d’une atteinte neuronale
L’exposition à l’hyperglycémie chronique engendre toute une cascade d’événements au niveau du capillaire rétinien :
- une occlusion des capillaires rétiniens, responsable d’une ischémie rétinienne, qui, lorsqu’elle s’étend, peut s’accompagner d’une prolifération de néovaisseaux à la surface de la rétine puis dans le vitré. Ces phénomènes occlusifs affectent principalement la rétine périphérique ;
- une hyperperméabilité de la paroi des capillaires rétiniens, source d’œdème rétinien. Prédominant volontiers au niveau de la macula, région centrale de la rétine, elle caractérise l’OMD. Ces deux processus pathologiques peuvent cœxister. Aussi est-il nécessaire d’évaluer, d’une part, la sévérité de l’ischémie rétinienne périphérique et son risque néovasculaire associé et, d’autre part, la sévérité de la maculopathie diabétique.
À cet effet, de nombreuses classifications de la RD et de l’OMD ont été proposées, dont l’objectif était notamment d’identifier les patients à haut risque de baisse visuelle. Ces classifications, en utilisant un langage standardisé, facilitent aussi la communication entre les différents professionnels intervenant auprès du patient diabétique.
Évaluer la sévérité de la RD et de l’OMD selon les classifications actualisées
Classification de la RD
Depuis la première classification de la RD en 1968, plusieurs classifications se sont succédé et ont été régulièrement adaptées par les différents collèges scientifiques. La classification détaillée dans le tableau 2 est une synthèse des classifications de l’ALFEDIAM et de la classification internationale de l’AAO (American Academy of Ophthalmology). Elle décrit les différents stades selon un degré croissant d’ischémie rétinienne ainsi que le risque néovasculaire et visuel qui en résulte.
L’évaluation de la sévérité de la RD est fondée sur l’analyse des lésions rétiniennes des 4 quadrants de la périphérie du fond d’œil à partir de photographies couleur. La réalisation d’une angiographie en fluorescence n’est le plus souvent pas nécessaire. Elle ne sera réalisée qu’en cas de suspicion de lésion néovasculaire. La pratique d’un OCT (tomographie en cohérence optique) est plutôt réservée à l’évaluation de la maculopathie diabétique.
*En l’absence de RD, ce délai de surveillance peut être augmenté à 2 ans chez les patients diabétiques non insulinotraités et dont le diabète et la pression artérielle sont équilibrés. **Dans tous les cas et à tous les stades de la RD, contrôle des facteurs de risque systémiques. ***Obligatoire dans certaines circonstances (situation à risque connu d’aggravation de la RD). RD : rétinopathie diabétique ; RDNP : rétinopathie diabétique non proliférante ; RDP : rétinopathie diabétique proliférante ; H/MA : hémorragies rétiniennes/microanévrismes ; AMIR : anomalie microvasculaire intrarétinienne ; HIV : hémorragie intravitréenne ; DP : diamètre papillaire ; HR : haut risque ; AV : acuité visuelle ; ETDRS : Early Treatment Diabetic Retinopathy Study ; FO : fond d’œil ; Photos : photographies du fond d’œil ; Angio : angiographie rétinienne OMD : œdème maculaire diabétique ; OCT : tomographie en cohérence optique ; PPR : photocoagulation panrétinienne ; IVT : injection intravitréenne
La RD débute par un stade de RD non proliférante (RDNP) comprenant 3 niveaux de sévérité par ordre croissant.
• Le premier stade correspond à la RDNP minime. Il est caractérisé par la présence de microanévrismes et/ou de microhémorragies rétiniennes dont l’augmentation et surtout le turn over (disparition de certains microanévrismes et apparition d’autres) est un bon indice de progression de la RD.
• Cette RDNP minime peut évoluer vers une forme modérée. Elle associe aux lésions précédentes des signes d’ischémie rétinienne (hémorragies rétiniennes profondes, anomalies veineuses en chapelet, anomalies microvasculaires intra-rétiniennes (AMIR) dont la sévérité n’atteint pas celle de la RDNP sévère.
• En effet, la RDNP sévère (ou RD préproliférante) est définie selon la règle du « 4-2-1 » par 3 critères dont un seul permet d’en poser le diagnostic : microanévrismes/ hémorragies nombreuses (> 20) dans chacun des 4 quadrants de la périphérie rétinienne et/ou veines en chapelet dans 2 quadrants et/ou AMIR sévères de grande taille dans un seul quadrant.
Ce stade de RDNP sévère correspond à un tournant évolutif dans l’évolution de la RD. En effet, à ce stade, l’ischémie rétinienne est suffisamment sévère pour exposer à un risque statistique de néovascularisation de 50 % à 1 an.
La RD proliférante (RDP) se caractérise ainsi par l’apparition de néovaisseaux en réponse à l’ischémie rétinienne étendue. Une prolifération fibrovasculaire peut y être associée. Des signes de gravité, associés à un pronostic visuel sévère, sont décrits dans le tableau 2. Ils caractérisent la RDP à haut risque.
Enfin, le dernier stade correspond à la RDP compliquée définie par la présence d’une hémorragie intravitréenne, d’un décollement de rétine, d’une rubéose irienne et/ou d’un glaucome néovasculaire.
Classification de l’OMD
Parallèlement, plusieurs classifications de l’OMD ont été proposées et celle actuellement retenue est dérivée de la classification internationale de l’AAO. Elle tient compte aussi des signes associés à un pronostic fonctionnel péjoratif. Évaluée à partir de photographies, elle est fondée sur la localisation de l’OMD par rapport au centre de la macula. Plus l’œdème est proche du centre, plus la menace visuelle est grande. Ainsi, un OMDminime correspond à une atteinte du pôle postérieur, mais à distance du centre de la fovéa. Il peut évoluer vers une forme modérée lorsqu’il s’approche du centre de la macula sans l’atteindre, puis vers une forme sévère lorsqu’il l’atteint. L’OMD tractionnel est défini par un épaississement rétinien maculaire associé à une traction vitréomaculaire ou à une membrane épimaculaire. Enfin, certains éléments tels qu’une ischémie maculaire sont considérés de mauvais pronostic.
Par ailleurs, cette classification sera probablement amenée à évoluer dès que la valeur pronostique des signes observés en OCT sera établie. En effet, la sévérité de l’OMD ne peut pas être évaluée uniquement sur l’épaisseur maculaire, son évolution n’étant pas strictement parallèle à celle de l’acuité visuelle. Par exemple, la réduction anatomique (diminution de l’épaisseur maculaire) observée sous traitement ne prédit pas pour autant la réponse visuelle.
Principales causes de baisse visuelle chez le patient diabétique
Plusieurs mécanismes peuvent rendre compte d’une baisse visuelle chez un patient diabétique. Il peut s’agir d’OMD responsable d’une diminution progressive de la vision centrale ou d’une hémorragie intravitréenne induisant une perte brutale et quasi complète de la vision. À un stade ultime de l’évolution de la RD, un décollement de rétine complexe et/ou un glaucome néovasculaire peuvent se compliquer d’une cécité définitive.
Néanmoins, cette baisse visuelle ne survient qu’après une très longue période d’évolution silencieuse pendant laquelle le dépistage précoce permet d’identifier les lésions rétiniennes et de les traiter avant que n’apparaissent ces complications.
Toute découverte de diabète doit s’accompagner d’un examen ophtalmologique complet
L’examen du fond d’œil doit être systématique à la découverte du diabète et quel qu’en soit le type (1, 2 ou autre). Les patients n’ayant pas de RD ou ayant une RDNP minime relèvent ensuite d’un dépistage annuel dont le rythme dépend du type de diabète et des facteurs de risque associés (figure 1). En revanche, en cas de lésions plus évoluées, ces patients doivent bénéficier d’un examen complet par un ophtalmologiste et d’une surveillance dont la fréquence et les modalités seront déterminées par la sévérité de l’atteinte (tableau 2).
Figure 1. Choisir le rythme du dépistage selon le type de diabète et les facteurs de risque associés. aChez le patient diabétique de type dès l’âge de 12 ans et être impérativement annuel à partir de 15 ans. bChez les patients diabétiques de type 2 sans RD, non insulinotraités et aux objectifs glycémique et tensionnel atteints : suvi suffisant tous les 2 ans. c6-8 % des patients diabétiques de type 2 présentent une RD à la découverte du diabète.
dIndiqué selon le type et la sévérité de l’atteinte. eAdolescents avec une durée de diabète de type 1 > 10 ans et contrôle glycémique insuffisant : surveillance ophtalmologique tous les 6 mois. fExamen ophtalmologique impératif avant la conception et surveillance ophtalmologique trimestrielle durant la grossesse (mensuel en cas de facteurs de risque de RD). gExamen ophtalmologique impératif avant intensification thérapeutique et surveillance ophtalmologique trimestrielle durant l’année suivante d’autant que le diabète est ancien, déséquilibré et la RD déjà présente.
Dépister
Favoriser l’adhésion au dépistage de la RD
Depuis plus de 20 ans, les recommandations pour le dépistage de la RD préconisent une surveillance annuelle du fond d’œil chez tous les patients diabétiques(4). Or, plusieurs enquêtes récentes menées par l’Assurance Maladie ou l’Institut national de veille sanitaire, dont l’étude ENTRED (Échantillon national témoin représentatif des personnes diabétiques), mettent en exergue l’insuffisance de dépistage de la RD en France dans la population diabétique.
Ainsi, les résultats de l’étude réalisée sur les données 2013 du SNIIRAM (Système national d’information inter-régimes de l’Assurance Maladie) révèlent que seuls 62 % des patients diabétiques de type 2 traités ont consulté un ophtalmologiste dans les deux précédentes années. De plus, cette fréquence du suivi ophtalmologique, déjà largement en dessous de l’objectif requis, ne s’est guère améliorée par rapport aux années précédentes contrairement aux autres examens recommandés dans la surveillance du patient diabétique(5).
De surcroît, au-delà de la difficulté d’accès aux ophtalmologistes, notamment dans certaines régions, le manque d’information des patients sur le risque de complications oculaires et l’importance d’un suivi régulier limitent leur adhésion à ce dépistage.
Modalités du dépistage de la RD
Le dépistage de la RD repose sur l’examen du fond d’œil, réalisé de préférence par photographies avec ou sans dilatation pupillaire. À défaut, l’ophtalmologiste peut l’effectuer par ophtalmoscopie indirecte à la lampe à fente après dilatation pupillaire.
Le dépistage de la RD peut être réalisé en dehors du cabinet de l’ophtalmologiste dans un site spécifique dédié au dépistage. Cette méthode consiste à déléguer la prise de photographies du fond d’œil à un(e) orthoptiste ou un(e) infirmièr(e) préalablement formé. Ces photographies sont prises à l’aide d’un rétinographe couleur avec ou sans dilatation pupillaire. Les images sont ensuite interprétées de façon différée par un ophtal mologiste spécialisé. Les modalités du dépistage sont résumées dans l’encadré ci-dessous. Le dépistage de la RD peut aussi être réalisé chez l’ophtalmologiste. Son intérêt est qu’il permet la réalisation d’un examen ophtalmologique complet de la périphérie du fond d’œil après dilatation pupillaire. Cet examen est, de toute manière, impératif dès le diagnostic de RDNP modérée ou d’une atteinte de gravité supérieure.
*Un suivi tous les 2 ans est suffisant chez les patients non insulinotraités dont les objectifs de contrôle glycémique et de pression artérielle sont atteints et sans RD(4).
Surveiller
La surveillance de la RD doit s’inscrire dans une coopération interdisciplinaire, articulée par une fiche de liaison
Le rythme de surveillance de la RD dépend des caractéristiques du patient (âge, type de diabète), de la sévérité de la RD, de la présence d’un OMD et de l’existence d’éventuelles circonstances aggravantes décrites ci-dessous.
Les délais et modalités de surveillance selon la sévérité de la RD et son risque évolutif sont rapportés dans tableau 2. Par exemple, le risque d’évoluer vers une RDP à 1 an chez un patient atteint de RDNP minime est faible, de l’ordre de 5 %, alors qu’il est proche de 50 % chez un patient atteint de RDNP sévère, justifiant une surveillance plus rapprochée assortie d’examens complémentaires et de traitement dans certains cas. La surveillance de la RD repose sur un examen ophtalmologique complet réalisé par l’ophtalmologiste. La photographie du fond d’œil en est l’examen de référence. En revanche, l’angiographie en fluorescence ne doit pas être demandée à titre systématique. Elle n’est pas indiquée pour le dépistage ou le suivi des stades précoces de RD ni pour celui d’une RD inactivée par le laser. Sa principale indication est l’évaluation initiale d’un OMD. Ses autres indications sont détaillées dans le tableau 2. Elle peut aussi contribuer à la recherche d’une cause devant une baisse visuelle inexpliquée. Quant à l’OCT, il est indispensable pour le diagnostic et l’évaluation de la maculopathie diabétique ainsi que pour son suivi.
Situations à risque d’aggravation de la RD
Certaines situations ou périodes de la vie sont clairement identifiées à risque d’évolution rapide de la RD. Il s’agit de l’adolescence, de la grossesse, au décours d’une amélioration rapide de la glycémie quelle qu’en soit la méthode thérapeutique, ou encore de la chirurgie de la cataracte (figure 2). Elles imposent toutes une surveillance rétinienne rapprochée dont la fréquence est détaillée ci-dessous.
Figure 2. Facteurs d’aggravation de la RD.
• Surveillance ophtalmologique de la RD en période post-pubertaire et durant l’adolescence
Alors que la prévalence de la RD chez les enfants diabétiques est très faible, avec notamment l’absence de RDP avant la puberté, l’adolescence constitue une période à haut risque d’évolution de la RD. En effet, les adolescents dont le diabète de type 1 évolue depuis plus de 10 ans avec un contrôle insuffisant (taux HbA1c > 10 %) sont à risque de développer une RD floride. Ils doivent impérativement bénéficier d’une surveillance ophtalmologique renforcée au moins tous les 6 mois, d’autant qu’il existe déjà des signes de RD.
• Surveillance ophtalmologique de la RD au cours de la grossesse
La grossesse est un facteur de risque connu de développement et de progression de la RD. Le taux de progression de la RD observé durant la grossesse varie dans les études selon la population étudiée (stade de la RD en début de grossesse, programmation de la grossesse, niveau du contrôle glycémique et tensionnel). Il est de l’ordre de 20 % dans les études les plus récentes où le taux de grossesses programmées est important et la normalisation glycémique précède la conception.
Les principaux facteurs de risque identifiés sont la durée d’évolution du diabète, la sévérité de la RD avant la grossesse, le mauvais contrôle glycémique à la conception, l’absence de programmation de la grossesse souvent associée à une normalisation glycémique rapide en début de grossesse et une hypertension artérielle préexistante ou gravidique. Cependant, même dans les grossesses programmées où le taux d’HbA1c est acceptable au moment de la conception, il persiste un risque de progression de la RD.
Ainsi, toute patiente diabétique doit bénéficier d’un dépistage de la RD avant la conception.
Il s’agit d’un élément nécessaire pour autoriser une grossesse. Une RDNP sévère ou une RDP avant la grossesse est une contreindication temporaire à une grossesse et une indication à un traitement par laser avant le début de grossesse.
Le suivi doit être ensuite trimestriel durant la grossesse et poursuivi dans le post-partum. Même chez des patientes indemnes d’atteinte rétinienne avant la grossesse, une RD peut apparaître dans un certain nombre de cas, justifiant aussi une surveillance ophtalmologique attentive chez ces patientes.
En présence d’un facteur de risque de progression de RD (RD préexistante, HTA, néphropathie, longue durée de diabète, absence de programmation de la grossesse, baisse de l’HbA1c au premier trimestre et ce, quel que soit le taux d’HbA1c à la conception), une surveillance ophtalmologique mensuelle est recommandée.
En cas de diabète gestationnel avéré chez une patiente dont la glycémie était normale avant la conception ou dans le premier trimestre, le suivi ophtalmologique n’est pas nécessaire. En revanche, en cas de découverte d’un diabète de type 2 au cours de la grossesse dont l’ancienneté n’est pas connue, une surveillance ophtalmologique se justifie.
• Surveillance de la RD après amélioration rapide de la glycémie
Certaines thérapeutiques administrées chez un patient diabétique de type 1 ou 2 non équilibré peuvent induire une amélioration glycémique rapide. Il peut s’agir de la mise sous pompe à insuline chez un patient diabétique de type 1 ou de l’optimisation thérapeutique chez un patient diabétique de type 2 en hyperglycémie chronique et chez lequel est instaurée une insulinothérapie. Une diminution rapide de la glycémie en période postopératoire peut aussi accompagner le succès d’une greffe pancréatique ou d’îlots ou apparaître dans les suites immédiates d’une chirurgie bariatrique.
Dans ces situations où l’intensification thérapeutique induit une baisse rapide de la glycémie, une aggravation de la RD a été observée chez 10 à 20 % des patients dans les 3 à 6 mois suivant l’amélioration glycémique(6). En l’absence de RD ou en présence d’une RDNP minime avant l’intensification thérapeutique, cette aggravation est en général limitée à des nodules cotonneux ou à des AMIR. Elle est alors souvent transitoire avec une régression possible des signes dans les 18 mois. En revanche, d’authentiques cas de lésions irréversibles ont été décrits, essentiellement chez des patients déjà atteints d’une RDNP modérée ou plus évoluée avant intensification thérapeutique.
Les principaux facteurs de risque d’aggravation identifiés sont la durée d’évolution préalable du diabète, le mauvais contrôle glycémique avant l’intensification thérapeutique ainsi que la sévérité initiale de la RD. En effet, la durée et l’importance du déséquilibre antérieur, c’est-à-dire la durée d’exposition antérieure à l’hyperglycémie paraissent déterminantes. L’existence d’une RD avant intensification thérapeutique, d’autant plus qu’elle est sévère, majore aussi le risque de progression comparé à celui de patients indemnes de RD initialement.
La forte amplitude de la baisse glycémique semble contribuer à l’aggravation, bien qu’il soit difficile de faire la part de chacun des facteurs, les patients les plus déséquilibrés étant ceux dont la baisse est la plus importante. En revanche, la vitesse de décroissance n’a pas été retenue comme facteur pronostique dans les études où elle était souvent la même chez les patients sous traitement intensif. De surcroît, aucune étude de prévention de l’aggravation par le contrôle de l’amplitude ou de la vitesse de décroissance n’a été menée à ce jour. Il n’y a donc, à ce jour, aucune preuve que contrôler la vitesse ou l’amplitude de la diminution de l’HbA1c permettrait de limiter ce risque d’aggravation. En outre, dans tous les cas, ajuster la vitesse de décroissance reste un exercice difficile, la réponse au traitement du patient n’étant pas toujours prévisible alors que sa volonté de normaliser son équilibre glycémique rapidement est forte à court terme dans un contexte de baisse visuelle.
En conséquence, un examen ophtalmologique s’impose avant toute intensification du traitement hypoglycémiant ou toute situation induisant une baisse rapide de la glycémie et quelle qu’en soit la méthode thérapeutique. Les résultats de cette évaluation ophtalmologique initiale guideront la stratégie de prise en charge. Un traitement par photocoagulation panrétinienne (PPR) doit être réalisé rapidement s’il existe une RDNP sévère et a fortiori une RDP lors de cet examen. L’intensification thérapeutique ne sera entreprise qu’après stabilisation de l’état rétinien mais peut débuter dans certains cas, et sous surveillance, dès que le traitement ophtalmologique a été initié.
Ensuite, une surveillance ophtalmologique trimestrielle durant l’année suivant l’amélioration glycémique est en général préconisée, d’autant plus que le diabète est ancien et déséquilibré et la RD déjà présente avant l’intensification thérapeutique. Le rythme de surveillance et le traitement seront ensuite fonction de la sévérité de l’atteinte. Enfin, la surveillance ophtalmologique ne doit pas être limitée aux seuls patients avec RD préalable. D’authentiques cas de RD florides après normalisation glycémique brutale ont été décrits chez les jeunes patients diabétiques de type 1 pourtant indemnes de RD avant l’intensification thérapeutique.
• Surveillance de la RD et de l’OMD après chirurgie de la cataracte
La cataracte survient plus fréquemment et à un âge plus précoce chez le patient diabétique que non diabétique. Ainsi, nombreux sont les patients diabétiques à bénéficier d’une chirurgie de la cataracte.
Compte tenu du risque d’aggravation d’une RD préexistante et/ou de survenue d’un OMD en postopératoire, il est essentiel de contrôler au mieux la glycémie et d’évaluer précisément l’atteinte rétinienne avant la chirurgie de la cataracte qui ne sera envisagée qu’après stabilisation de la RD et contrôle de l’OMD. Un traitement par laser et/ou par injections intravitréennes d’anti-VEGF (Vascular Endothelial Growth Factor) ou de corticoïdes peut alors être indiqué en période préopératoire. En outre, une injection intravitréenne peut aussi être réalisée pendant l’acte chirurgical pour prévenir l’aggravation éventuelle d’un OMD déjà présent en préopératoire. La surveillance ophtalmologique sera ensuite renforcée pendant l’année postopératoire.
Traiter
Contrôler les facteurs systémiques (glycémie et pression artérielle)
Le contrôle des facteurs systémiques, au premier rang desquels figurent le contrôle glycémique et tensionnel, reste la pierre angulaire du traitement de la RD et/ou de l’OMD et, ce, quel que soit le stade de l’atteinte rétinienne. De larges études d’intervention menées aussi bien dans le diabète de type 1(6) que de type 2(7,8) ont clairement démontré le bénéfice d’un contrôle intensif de la glycémie sur l’incidence et la progression de la RD. L’instauration d’un contrôle glycémique optimal dès le diagnostic du diabète a, en outre, une incidence positive à long terme sur l’évolution de la RD en se fondant sur le concept de mémoire glycémique. En témoignent les résultats favorables du suivi prolongé, plusieurs années après la fin de ces études, des patients initialement inclus dans le groupe « intensif »(9-12).
Ainsi, un objectif d’HbA1c proche de 7 %, tout en étant personnalisé, permet d’observer un bénéfice à tous les stades de la RD. Il prévient la survenue d’une RD, favorise sa régression au stade précoce et réduit la progression vers la RDP et la baisse visuelle. Néanmoins, la prudence reste de mise en cas d’intensification thérapeutique chez un patient dont le diabète est ancien, préalablement déséquilibré et compliqué d’une RD. Dans ce contexte, l’amélioration glycémique rapide induite par les traitements peut s’accompagner d’une aggravation de la RD, comme décrite ci-dessus, et justifie d’une vigilance particulière et d’un examen ophtalmologique préalable.
Au même titre que l’hyperglycémie, l’hypertension artérielle participe au développement et à l’aggravation de la RD. Ainsi, l’amélioration tensionnelle est un paramètre déterminant dans la prévention de la progression de la RD. Chez des patients atteints de RD, un objectif de pression artérielle proche de 130/80 mmHg est recommandé. Des objectifs tensionnels plus stricts, notamment une pression systolique < 120 mmHg, n’apportent aucun bénéfice supplémentaire(8).
Par ailleurs, en cas d’OMD, le contrôle essentiel de la pression artérielle légitime la pratique d’une MAPA (mesure ambulatoire de la pression artérielle) pour s’assurer de l’atteinte des objectifs sur l’ensemble du nycthémère. Enfin, une métaanalyse récente suggère que les inhibiteurs du système rénine angiotensine (IEC ou ARA2) seraient bénéfiques pour freiner la progression ou favoriser la régression des signes précoces de la RD chez les patients diabétiques normotendus(13). En revanche, chez le patient hypertendu, l’essentiel est de normaliser la pression artérielle, indépendamment de la classe thérapeutique.
Dépister et traiter le syndrome d’apnée du sommeil
Une association a été mise en évidence dans plusieurs études entre syndrome d’apnée du sommeil (SAS), RD et/ou OMD. Bien que les études manquent aujourd’hui pour démontrer le bénéfice de la correction du SAS sur l’évolution de la RD, la recherche systématique d’un SAS est néanmoins recommandée en cas d’OMD.
Contrôler les facteurs de risque cardiovasculaire
(figure 3)
Figure 3. La rétinopathie diabétique : marqueur de risque cardiovasculaire. type 1.
La présence d’une RD est un marqueur du risque cardiovasculaire (CV) comme en témoigne l’augmentation du risque d’événements CV chez le patient diabétique atteint de RD. Kramer et coll., dans une métaanalyse regroupant une vingtaine d’études et près de 20 000 patients, ont montré que le risque de mortalité toutes causes et/ou d’événements CV était multiplié en présence d’une RD par 2,34 chez les patients diabétiques de type 2 et par 4,10 chez ceux de type 1 comparés aux patients diabétiques indemnes de RD(14). Ces associations persistaient après ajustement pour les autres facteurs de risque CV. En outre, le niveau de risque CV était corrélé à la sévérité de la RD.
Ainsi, une atteinte cardiovasculaire doit être recherchée attentivement chez un patient atteint de RD, d’autant plus que les lésions rétiniennes sont sévères et un traitement par injection intravitréenne d’anti-VEGF envisagé.
Parallèlement, dans ce contexte, l’ensemble des facteurs de risque vasculaire doit être contrôlé.
Une dyslipidémie doit être recherchée et traitée le cas échéant. En effet, des anomalies lipidiques sont classiquement associées à la présence d’exsudats rétiniens. En outre, des études récentes suggèrent un rôle potentiel des fibrates dans la prise en charge de la RD, le fénofibrate ayant réduit la progression de la RD dans deux essais randomisés : FIELD(15) et ACCORD(8). Cependant, l’objectif principal de ces études était d’évaluer le bénéfice cardiovasculaire du fénofibrate et le niveau de preuve reste, à ce jour, insuffisant pour proposer cette classe thérapeutique en première intention.
Par ailleurs, bien que le rôle du tabac dans la RD soit controversé, le sevrage tabagique doit être encouragé comme chez tous les patients diabétiques. Ceux atteints de RD doivent, de plus, être informés de l’augmentation de leur risque d’événements CV, les incitant encore plus à débuter un sevrage tabagique.
Enfin, l’activité physique doit être favorisée chez les patients atteints de RDNP et dès lors que la RDP est traitée.
Il faut souligner aussi l’absence de contre-indication ophtalmologique à la prescription d’un antiagrégant plaquettaire chez un patient atteint de RD. En effet, l’étude ETDRS a clairement démontré que l’aspirine n’augmente pas ni risque d’hémorragie intravitréenne, ni sa sévérité, ni sa durée.
Mettre en place une éducation thérapeutique adaptée et ciblée chez le patient
Chez un patient diabétique atteint d’une RD, l’éducation thérapeutique doit s’attacher à expliquer les bénéfices attendus des traitements et l’importance du suivi ophtalmologique proposé afin d’optimiser l’observance thérapeutique.
Le patient doit aussi être informé des situations où l’évolution de la RD peut être rapide et la surveillance ophtalmologique nécessairement rapprochée, telles que la période post-pubertaire et l’adolescence, la grossesse, après une amélioration glycémique rapide ou dans les suites d’une chirurgie de la cataracte.
Enfin, en cas de déficit visuel, le matériel utilisé pour l’autosurveillance et le traitement par voie injectable doivent être adaptés à la malvoyance.
Une attention particulière sera de plus portée au suivi podologique de ces patients, souvent aussi atteints d’une neuropathie périphérique. Dans certains cas, une rééducation basse vision ou des contacts avec les associations de malvoyants peuvent être proposés.
Traitement ophtalmologique
Photocoagulation panrétinienne
La photocoagulation panrétinienne (PPR) est le traitement de référence de la RDP. Son rythme dépend de la sévérité de la RD et d’éventuelles circonstances aggravantes. Elle peut être proposée à titre préventif dès le stade de RDNP sévère où elle devient obligatoire dans les situations où l’évolution de la RD peut être rapide (grossesse, amélioration rapide de la glycémie induite par une intensification thérapeutique, durant l’adolescence, avant ou après chirurgie de la cataracte). Par ailleurs, elle peut être aussi indiquée chez un patient dont le suivi sera difficile.
Dans certaines situations, des injections intravitréennes d’anti- VEGF peuvent être administrées en association avec le traitement par laser, notamment en cas d’OMD associé.
Injections intravitréennes d’anti-VEGF ou de corticoïdes
Les injections intravitréennes d’anti-VEGF ou de corticoïdes constituent le traitement de première intention de l’OMD entraînant une baisse visuelle. Toutefois, l’équilibre des facteurs systémiques, notamment de l’HTA, est indispensable dans tous les cas pour traiter l’OMD.
Vitrectomie
Certaines situations peuvent justifier d’une vitrectomie : hémorragie du vitré compliquant une RDP compliquée et empêchant la réalisation de la PPR, décollement de rétine tractionnel décollant la macula ou encore OMD tractionnel. Dans tous les cas, une PPR sera réalisée en parallèle et/ou complétée en peropératoire.
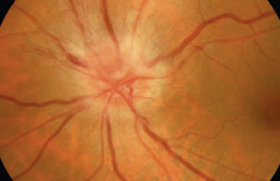
RDP et OMD chez un homme diabétique de type 2.
Hémorragie intravitréenne compliquant une rétinopathie proliférante chez une jeune patient diabétique de type 1.
Conclusion
La prise en charge de la RD se doit d’être précoce, individualisée et en étroite collaboration avec l’ensemble des partenaires de santé intervenant auprès du patient diabétique.
Des actions telles que l’incitation au dépistage de la RD, la correction de l’ensemble des paramètres métaboliques et tensionnels ainsi que des facteurs de risque vasculaire associés, doivent être mises en place dès le diagnostic du diabète. Elles contribuent déjà largement à améliorer le pronostic visuel des patients diabétiques.
Enfin, aidé des nouvelles méthodes d’imagerie oculaire et de traitement, le suivi ophtalmologique est aujourd’hui facilité pour les patients diabétiques chez lesquels prévenir ou tout au moins limiter les complications rétiniennes reste un enjeu majeur de santé publique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :