Insuline
Publié le 19 juin 2016Lecture 12 min
Les biosimilaires de l’insuline : identiques ou différents de l’original ?
L. MONNIER, C. COLETTE, Institut universitaire de recherche clinique, université de Montpellier
Bien que le terme « biosimilaire » soit moins familier que le terme « générique », le concept est le même. La seule différence réside dans le fait que le « générique » est la copie a priori identique d’un médicament de nature chimique alors que le « biosimilaire » est la copie a priori identique d’une substance biologique (en général de nature protéique) à visée thérapeutique. Ainsi défini, le « biosimilaire » doit avoir la même structure chimique, les mêmes propriétés physico-chimiques et, par-delà, la même efficacité et sûreté clinique que le produit original dont il est sensé être la copie. Étant donné que les procédés de production et le conditionnement diffèrent sensiblement entre les biosimilaires et la substance mère, il est légitime de se poser la question de savoir si ces produits sont en tout point identiques à l’original quand il s’agit de les prescrire à des patients.
Cette question s’est évidemment posée pour les « biosimilaires » de la glargine. Rappelons que cette préparation insulinique a été commercialisée il y a plus de 10 ans sous le nom de Lantus® et qu’elle a obtenu son autorisation de mise sur le marché dans l’Union européenne sous la forme d’une préparation injectable titrée à 100 unités/ml, le 9 juin 2000 (Agence européenne du médicament ou EMA pour European Medicines Agency).
La Lantus® est aujourd’hui considérée comme le produit référent en matière d’insuline basale, compte tenu de sa durée d’action qui est de l’ordre de 24 heures(1). Après plus de 10 ans d’utilisation avec succès, il n’est pas étonnant que plusieurs laboratoires de l’industrie pharmaceutique aient décidé de se lancer dans le développement et la production de biosimilaires de la glargine. Avec la mise sur le marché d’Abasaglar®, premier biosimilaire de l’insuline glargine, il nous paraît intéressant de faire une analyse comparative par rapport à la préparation mère, la Lantus®.
Modes de production des biosimilaires de la glargine
Comme la Lantus®, les biosimilaires de la glargine sont produits par biosynthèse grâce à la technologie de l’ADN recombinant en utilisant une souche modifiée d’Escherichia coli. La séquence primaire d’acides aminés est identique dans les biosimilaires de la glargine et la Lantus®. Les modifications de structure par rapport à l’insuline humaine native sont constituées par :
- une élongation de l’extrémité carboxy terminal de la chaîne B grâce à l’addition de 2 résidus arginine en position B31 et B32 ;
- et par le remplacement en A21 de l’asparagine par la glycine (figure 1).
Figure 1. Structure primaire de l’insuline glargine et de ses métabolites. Le métabolite circulant principal, qui véhicule la majorité des effets métaboliques de la glargine, est le métabolite M1 dont la structure primaire est très proche de l’insuline humaine native.
Ces deux changements de structure entraînent le déplacement du point isoélectrique (pHi) de la glargine vers un pH neutre (voisin de 7) avec pour conséquence une microprécipitation dans le tissu cellulaire sous-cutané après injection. C’est par ce biais que la résorption du dépôt injecté devient beaucoup plus longue pour atteindre 24 heures. Toutefois, il est bien connu que la structure primaire d’une protéine, même si elle joue un rôle essentiel, n’est pas suffisante.
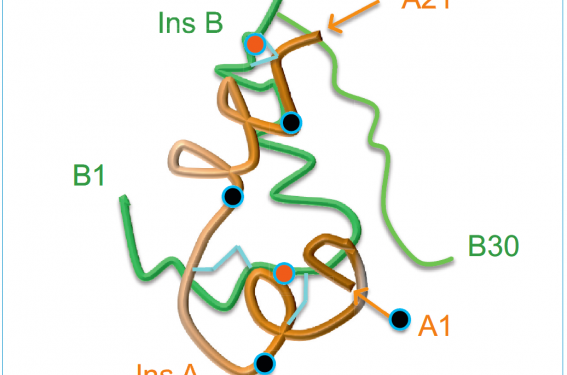
Les propriétés d’une protéine (par exemple la fixation sur ses récepteurs spécifiques et leur activation ultérieure) sont également conditionnées par sa configuration stéréochimique qui est caractérisée par une plicature de la molécule et par la présence de chaînes hélicoïdales (de type α). À titre d’exemple, l’insuline native est constituée de 2 chaînes protéiques A (21 acides aminés) et B (30 acides aminés) reliées par 2 ponts disulfures (A7-B7 et A20-B19)(2,3) :
- la chaîne A contient également un pont disulfure entre les acides aminés A7 et A11. En ce qui concerne la configuration spatiale (figure 2), la chaîne A possède 2 séquences hélicoïdales de type α antiparallèles, l’une N terminale entre les positions A1 et A8, l’autre C terminale entre les positions A12 et A20 ;
- la chaîne B possède une séquence hélicoïdale de type a qui s’étend normalement de la position B8 à la position B19, mais qui peut aller de la position B1 à la position B19(2,3). La première configuration de la chaîne B est la plus fréquente (forme étirée ou « tense »), la deuxième est une configuration alternative (forme relâchée ou « relax ») que l’on rencontre en particulier dans les insulines qui se « protractent » au niveau du dépôt sous-cutané après injection(4,5).
En dépit des variations concernant la technique de production des biosimilaires de la glargine et de son produit mère la Lantus®, la structure spatiale est identique pour les 2 types de préparations(6). La libération ultérieure des métabolites actifs circulants (métabolite M1 en particulier) par perte des 2 résidus arginine en B31 et B32 est également identique. Dans ces conditions, et malgré quelques différences mineures au niveau des excipients utilisés, il est a priori permis de penser que les caractéristiques pharmacocinétiques, pharmaco-dynamiques, pharmacologiques et cliniques des biosimilaires de la glargine sont totalement comparables à celles de la Lantus®. C’est cette identité que nous allons documenter dans les lignes qui suivent.
Figure 2. Structure stéréochimique de l’insuline humaine. Les deux chaînes A (21 acides aminés) et B (30 acides aminés) ont une configuration compacte en s’enroulant l’une sur l’autre et en se plicaturant. La présence de ponts disulfures (indiquée en bleu clair) est un facteur majeur pour stabiliser la configuration naturelle de l’insuline (d’après la référence 2). La chaîne A (A1-A21) contient 2 séquences alpha-hélicoïdales entre A1-A8 et A12-A18. La chaîne B (B1-B30) contient 1 séquence alpha-hélicoïdale entre B8-B19. Forme T. La chaîne B contient 1 séquence alpha-hélicoïdale entre B1-B19. Forme R.
Identité pharmacologique entre biosimilaires de la glargine et Lantus®
Toutes les études sur les biosimilaires de la glargine ont globalement montré qu’ils ont la même affinité pour les récepteurs insuliniques que le produit mère (Lantus®) et qu’ils activent ces récepteurs (autophosphorylation) de manière identique(6). Les quelques petites différences qui ont été observées sont minimes et n’ont jamais été considérées comme biologiquement significatives. De surcroît, le potentiel mitogène des biosimilaires de la glargine sur des lignées de cellules ostéo-sarcomateuses humaines n’a pas montré de différence significative(6). Ainsi, les études ex vivo conduisent à la conclusion que les potentiels métaboliques, lipogéniques et mitogènes des biosimilaires ne présentent aucune différence par rapport à la Lantus®(6). De toute manière, il convient de se rappeler que l’action de la glargine s’exerce par l’intermédiaire de son métabolite principal, le métabolite M1, qui ne se distingue de l’insuline humaine native que par la présence d’un résidu glycine à la place de l’asparagine en position A21. Cette simple constatation laisse penser que la glargine a les mêmes effets que l’insuline native une fois qu’elle a donné naissance à son métabolite M1. Ce fait a été démontré par plusieurs études(7,8).
Les études de pharmacocinétique
Elles consistent à doser la concentration de l’insuline à tester après administration sous-cutanée. Dans une étude récente comparant la pharmacocinétique de la Lantus® avec celle du biosimilaire développé par le laboratoire Lilly, Abasaglar®, il a été démontré que les concentrations insuliniques sont identiques pour les 2 produits (figure 3)(9). Il convient toutefois de noter que, malgré le nombre important de sujets (n = 211), cette étude a été critiquée car conduite chez des volontaires sains(10). Normalement, le dosage de la concentration plasmatique de l’insuline à tester ne peut être interprété de manière correcte que si l’insulinosécrétion endogène est absente. C’est pour cette raison que les études de la pharmacocinétique des insulines sont en général réalisées chez des diabétiques de type 1 « insulinoprives ». Dans cette étude, la présence de l’insulinosécrétion endogène a été corrigée en soustrayant de la concentration insulinique totale la concentration du peptide C corrigée par un coefficient évaluant à l’état de base le rapport concentration de l’insuline/concentration du peptide C. La formule exacte est la suivante : [IGlar testée] = [Insuline totale] – F* [peptide C] où F* = rapport [insuline]/[peptide C] à l’état de base avant injection de l’insuline à tester. Cette méthode décrite par Owens et coll.(11) reste bien sûr critiquable.
Figure 3. Profils de réponses insuliniques corrigés par la concentration du peptide C plasmatique au cours de clamps euglycémiques après injection de préparations insuliniques par voie sous-cutanée au temps 0 chez des volontaires sains non diabétiques. Comparaison d’un biosimilaire de la glargine (Abasaglar®) et de la Lantus® approuvée en Europe (d’après la référence 9).
Il n’en reste pas moins que, même si la mesure est entachée d’erreurs, les profils pharmacocinétiques sont a priori identiques avec le biosimilaire de la glargine Abasaglar® et la Lantus®. Pour cette raison, cette méthode garde toute sa valeur quand il s’agit de comparer une insuline à tester (Abasaglar® par exemple) et un produit de référence comme la Lantus®. Toutes les comparaisons qui ont été effectuées (Abasaglar® versus Lantus® approuvée aux États-Unis ; Abasaglar® versus Lantus® approuvée en Europe et Lantus® approuvée aux États-Unis versus Lantus® approuvée en Europe ont montré des profils pharmacocinétiques identiques(9). Pour des raisons de simplicité, nous avons limité la représentation graphique à la comparaison des profils entre Abasaglar® et Lantus® approuvée en Europe (figure 3).
Les études de pharmacodynamie
Elles ont pour objectif d’étudier l’activité d’une insuline à tester en mesurant le débit de glucose infusé par voie intraveineuse (GIR pour Glucose Infusion Rate) nécessaire pour maintenir une glycémie relativement stable, aux alentours de la normale, après une injection sous-cutanée de cette variété d’insuline (clamp euglycémique). Comme pour les études de pharmacocinétique, il est préférable de réaliser les tests de pharmacodynamie chez des diabétiques de type 1 insulinoprives. Dans l’étude comparant le biosimilaire de la glargine Abasaglar® à son produit mère la Lantus®, ce sont comme nous l’avons indiqué plus haut des volontaires sains qui ont été inclus dans l’étude(9). Pour cette raison, les réserves sur la méthodologie que nous avons émises pour l’interprétation des études de pharmacocinétique doivent être appliquées aux études de pharmacodynamie. La plus importante est la persistance d’une sécrétion insulinique endogène qui « pollue » les résultats de l’activité de l’insuline exogène à tester. Cette restriction ayant été soulignée, il n’en reste pas moins que les résultats restent interprétables dans la mesure où cette étude repose sur la comparaison du biosimilaire de la glargine et de la Lantus® et dans la mesure où les failles inhérentes à la technique du clamp euglycémique sont a priori les mêmes pour les 2 préparations insuliniques. Les résultats obtenus dans cette étude ont montré que les GIR sont strictement identiques avec le biosimilaire Abasaglar® et la Lantus® (figure 4)(9).
Figure 4. Profils des débits de glucose intraveineux (GIR : Glucose Infusion Rate) au cours de clamps euglycémiques après injection de préparations insuliniques par voie sous-cutanée au temps 0 chez des volontaires sains non diabétiques. Comparaison d’un biosimilaire de la glargine (Abasaglar®) et de la Lantus® approuvée en Europe (d’après la référence 9).
Pour conclure ce chapitre sur la pharmacologie comparative des biosimilaires de la glargine et de la Lantus®, il est possible d’affirmer sans aucune ambiguïté que les 2 variétés de produits ont les mêmes propriétés pharmacologiques et les mêmes comportements pharmacocinétiques et pharmaco-dynamiques. Ces observations permettent a priori de penser que l’efficacité et la sécurité clinique devraient être identiques.
Identité d’efficacité clinique
Elle est en général testée au cours d’études cliniques de phase 3. Pour le biosimilaire de la glargine Abasaglar®, 2 études ont été conduites(6). La première a été réalisée chez des patients diabétiques de type 1 (étude ELEMENT1) traités par un schéma basal-bolus depuis au moins un an. L’autre étude a été effectuée chez des patients diabétiques de type 2 (étude ELEMENT2). Dans l’étude ELEMENT2, les diabétiques de type 2 ont été recrutés parmi des sujets traités par antidiabétiques oraux dont la majorité recevaient un traitement par Lantus® avant l’entrée dans l’étude. Dans le groupe Abasaglar®, 81,3 % recevaient déjà de la Lantus® au moment de l’entrée dans l’étude. Ce pourcentage était de 87,6 % pour ceux qui furent affectés au groupe Lantus®. Dans ces 2 études randomisées (ELEMENT1 et ELEMENT2), le biosimilaire de la glargine a été comparé à la Lantus®, avec une durée de suivi de 24 semaines. Ces études multicentriques ont été réalisées sur un nombre important de sujets (509 et 662 respectivement pour les études ELEMENT1 et ELEMENT2). L’objectif principal de ces études était de démontrer la non-infériorité du biosimilaire de la glargine par rapport à la Lantus® en prenant comme critère principal d’efficacité l’évolution de l’HbA1c entre le moment de l’entrée dans l’essai et la fin du suivi au bout de 24 semaines.
Les résultats sont consignés sur les tableaux 1 (étude ELEMENT1) et 2 (étude ELEMENT2). Ils montrent que la baisse de l’HbA1c (modeste dans le type 1, plus marquée dans le type 2), l’augmentation du poids corporel (faible dans le type 1, un peu plus importante dans le type 2), l’augmentation des doses d’insuline (pratiquement nulle dans le type 1, assez marquée dans le type 2) sont en tout point identiques lorsque le biosimilaire de la glargine est comparé à la Lantus®. Par ailleurs, le nombre d’hypoglycémies totales et d’hypoglycémies nocturnes a été trouvé légèrement inférieur avec le biosimilaire de la glargine comparé à la Lantus®. Toutefois, la différence n’est pas significative. Ainsi, sur les critères principaux (HbA1c, poids, doses d’insuline, hypoglycémies), il apparaît que le biosimilaire de la glargine et le produit mère donnent des résultats parfaitement superposables.
Tableau 1. Comparaison des effets cliniques de la glargine (Abasaglar®) et du produit mère (Lantus®) chez des diabétiques de type 1 (étude ELEMENT1).
Le symbole Δ indique la variation des paramètres considérés entre l'état de base et la fin de l'essai au bout de 24 semaines (d'après la référence 6).
Tableau 2. Comparaison des effets cliniques du biosimilaire de la glargine (Abasaglar®) et du produit mère (Lantus®) chez des diabétiques de type 2 (étude ELEMENT2).
Le symbole Δ indique la variation du paramètre considéré entre l'état de base et la fin de l'essai au bout de 24 semaines (d'après la référence 6).
Conclusions générales
Les biosimilaires de la glargine et le produit mère (Lantus®) ont des propriétés totalement identiques en termes de pharmacologie et d’effets cliniques (efficacité, sécurité). Ceci n’a rien de surprenant puisque les produits ont la même structure stéréochimique et dans la mesure où c’est cette structure qui conditionne la résorption dans le tissu cellulaire sous-cutané, la transformation en métabolites actifs (métabolites M1 principalement) et leur fixation ultérieure sur les récepteurs insuliniques pour activer la cascade métabolique qui conduit aux effets de l’insuline.
Ainsi, il apparaît donc que toute polémique autour de la non-identité des effets biosimilaires de la glargine par rapport à la Lantus® ne serait qu’une « tempête dans un verre d’eau ». Ces conclusions ne sont évidemment valables que pour les « biosimilaires » qui ont accepté de passer par les procédures de certification imposées par les autorités américaines (FDA pour Food and Drug Administration) ou européennes (EMA). En effet, la structure stéréochimique du produit final ne peut être garantie comme identique à l’original que si les procédés de fabrication et de purification ont été scrupuleusement respectés(6).
À ce jour, il existe plusieurs procédés de fabrication. Tous ont recours à la technique de l’ADN recombinant. En général, ils consistent à produire de la pro-insuline (figure 5), à ouvrir les ponts disulfures qui risquent de ne pas être en position adéquate après la phase initiale de biosynthèse, à reconfigurer la molécule de pro-insuline en réintroduisant les ponts disulfures dans leur position adéquate, et à retirer le peptide C par digestion enzymatique pour obtenir le produit final. Ce dernier, après avoir été débarrassé de ses impuretés puis cristallisé et stérilisé, conduit à la préparation commerciale définitive. D’autres procédures consistent à synthétiser les chaînes A et B de l’insuline pour obtenir un complexe protéique dans lequel il faut introduire les ponts disulfures en position adéquate. Ce procédé, qui nécessite 2 fermentations au lieu d’une, est plus complexe que le premier qui fait appel à une seule fermentation. Pour cette raison, c’est le premier procédé qui est habituellement retenu.
Figure 5. Les différentes étapes de la synthèse de la glargine. La technique de l’ADN recombinant permet de synthétiser la pro-insuline, mais la configuration compacte ne peut être obtenue qu’après suppression et reconstitution des ponts disulfures (cycle de dénaturation-renaturation). La pro-insuline est alors soumise à l’action d’une endopeptidase qui clive la structure entre les acides aminés B32 et B33 pour libérer la glargine d’un côté et le peptide C de l’autre (d’après la référence 12).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :