Ophtalmologie
Publié le 18 oct 2021Lecture 17 min
La télémédecine et l’intelligence artificielle au service du dépistage et du suivi de la rétinopathie diabétique
Marine PAUL*, Pascale MASSIN**, Alfred PENFORNIS***, *Endocrinologie, Hôpital Cochin, APFP, Paris ; **Ophtalmologue, Paris ; ***Endocrinologie-diabétologie, CH Sud-Francilien, Corbeil-Essonnes

Au cours de sa vie, plus d’un patient diabétique sur trois sera atteint de rétinopathie diabétique (RD), la complication microvasculaire la plus courante de la maladie et une des principales causes mondiales de cécité. La télémédecine et l’intelligence artificielle (IA) se développent pour permettre au plus grand nombre de patients d’accéder au dépistage et nous aident à composer avec l’expansion majeure de la maladie, faisant face à une démographie médicale en baisse, très inégale d’une région à l’autre. Ces outils doivent aujourd’hui s’intégrer dans le parcours du dépistage et du suivi de la RD.
Recommandations actuelles de dépistage et de suivi
Le dépistage de la RD soulève en premier lieu la question du délai de réalisation de l’examen ophtalmologique initial. Pour les patients vivant avec un diabète de type 1 (DT1), les sociétés savantes internationales n’ont pas les mêmes recommandations en ce qui concerne la réalisation du premier examen, recommandé au diagnostic en France (référentiels de la Société francophone du diabète [SFD] et de la Société française d’ophtalmologie [SFO]) et pouvant aller jusqu’à cinq ans après la découverte pour l’American Diabetes Association (ADA) et l’American Association of Ophthalmology (AAO). Elles sont par ailleurs unanimes en ce qui concerne le patient diabétique de type 2 qui doit bénéficier d’un examen à la découverte, la durée d’exposition antérieure à l’hyperglycémie étant inconnue et potentiellement prolongée. Pour ce qui est du rythme de surveillance si cet examen est normal, toutes s’accordent à dire qu’une surveillance annuelle est préconisée, pouvant éventuellement être espacée tous les deux ans sous certaines conditions (patient diabétique de type 2 sans insulinothérapie avec bon équilibre glycémique et tensionnel). À l’avenir, il est probable que ces intervalles de dépistage puissent être individualisés et aller jusqu’à une fois tous les 3 ou 4 ans chez les sujets ayant le risque de RD le plus faible.
Le dépistage a pour objectif de déterminer qui peut simplement faire l’objet de cette surveillance annuelle et qui nécessite un suivi ophtalmologique rapproché. C’est parce qu’il existe des thérapeutiques qui ont prouvé leur efficacité si elles sont réalisées au bon moment que le rythme des contrôles s’intensifie, allant de tous les six à douze mois, tous les quinze jours selon la sévérité de l’atteinte. Ces recommandations s’appuient sur les classifications de la RD et de l’œdème maculaire (OM), qui découlent de la recherche des lésions spécifiques et de leurs complications à l’examen ophtalmologique.
L’examen de dépistage est la clé de toute la prise en charge de la pathologie et, grâce à lui, il est possible d’éviter l’évolution vers la cécité. Les recommandations pour sa réalisation dépassent largement les capacités d’accueil des ophtalmologistes et la télémédecine a apporté des solutions prometteuses pour la généralisation de cet examen au sein d’une population diabétique grandissante.
L’essor de la téléophtalmologie
Historiquement, la télémédecine a commencé à se développer lorsque l’on a envisagé d’envoyer des hommes dans l’espace, dans les années 1960. Il s’agissait alors de surveiller à distance les paramètres vitaux des astronautes. L’explosion des nouvelles technologies a rendu la télétransmission d’informations, notamment médicales, simple et applicable à de nombreux domaines, dont l’ophtalmologie. Nous devons l’engouement de la télémédecine pour cette spécialité aux technologies de pointe ayant rapidement permis d’acquérir des images de qualité, support du travail de l’ophtalmologiste. Lorsque l’on passe en revue la littérature des dernières années, la téléophtalmologie s’impose comme un moyen fiable, permettant d’améliorer le taux de participation au dépistage, rentable et accepté par la population.
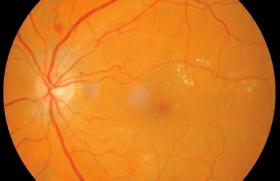
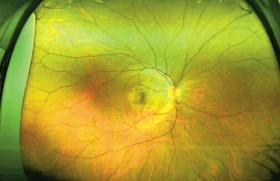
Depuis les années 1980, il a été montré que les photographies de fond d’œil permettent un diagnostic tout aussi performant de la RD que l’examen direct par ophtalmoscope. La prise de photographies non simultanées et en couleurs, de sept champs standards de la rétine de 30° en situation mydriatique, s’est imposée comme l’examen de référence pour le diagnostic de la RD et a été validée par de nombreux groupes de travail. L’arrivée du numérique a permis de remplacer les images capturées jusque-là sur films standards et de nouveaux appareils à large champ ont permis l’obtention d’images comparables et inter- prétables, sans recours au collyre mydriatique. Il a alors été admis comme fiable de numériser et sauvegarder un grand nombre de clichés capturés par des personnels non médicaux, puis de les télétransmettre pour interprétation.
En ce qui concerne l’accès au dépistage, plusieurs études randomisées ont établi une plus grande adhésion du groupe télémédecine par rapport à ceux bénéficiant d’une consultation ophtalmologique classique, pouvant aller du simple au double. Le taux de participation au dépistage est de 94,6 % contre 43,9 % dans les six premiers mois dans l’un des plus grands essais cliniques randomisés multicentriques ayant pour objectif de comparer l’efficacité sur le long terme d’un programme de télémédecine, par rapport à un examen ophtalmologique standard. De plus, un nombre grandissant de patients au fil du temps a recours au dépistage par téléophtalmologie lorsque les deux modes de dépistage sont proposés. Dans ce sens, il est observé une amélioration de l’accès au dépistage dans les populations rurales.
Sur le plan économique, une dizaine d’études ont évalué la rentabilité de la téléophtalmologie pour le dépistage de la RD et toutes concluent à la rentabilité du système. Cela a été montré au sein de populations très diversifiées, à l’aide de différents outils d’analyse économique, allant de l’estimation du coût du dépistage au calcul du ratio de retour sur investissement (à anticiper pour la mise en place du système et des installations).
Enfin, lorsque l’on interroge la satisfaction du patient face à ce mode de dépistage, peu d’études ont réussi à l’évaluer de manière objective et se comptent sur les doigts d’une main celles qui en ont fait leur critère de jugement principal. Pour celles dont nous disposons, cette méthode est acceptable et même préférée à l’examen classique pour plus de 95 % des patients et moins de 5 % déclarent ne pas faire confiance à cette technologie.
État des lieux de la téléophtalmologie en France
Aujourd’hui, les appareils de capture d’images peuvent être placés au sein de centres de dépistage de services hospitaliers, intégrés à des systèmes de dépistage mobiles ou placés directement dans le cabinet d’autres professionnels de santé, comme les médecins généralistes. Ces clichés sont centralisés puis interprétés par des ophtalmologistes entraînés.
Actuellement, le dépistage de la RD peut s’effectuer par télémédecine pour les patients n’ayant pas de RD connue ou une RD non proliférante (RDNP) minime. À partir de la RDNP modérée, le patient doit entrer dans un suivi ophtalmologique classique. L’apport de ce système est majeur en termes de gain de temps pour l’ophtalmologiste, dont les plages de consultation sont désengorgées des patients répondant à une simple surveillance annuelle. Le temps qu’ils consacrent à ces patients, limité à la lecture d’images préalablement stockées, est divisé par quatre ! Sur le plan économique, une étude réalisée en collaboration avec le Département de pharmaco-épidémiologie du Centre hospitalier universitaire de Lyon a évalué l’impact de la télémédecine sur trois parcours de soins, dont le diabète de type 2. Ils ont estimé le coût des soins en prenant en compte les traitements médicamenteux, les dispositifs médicaux, les consultations médicales, les consultations de paramédicaux, les actes techniques médicaux de ville, les examens biologiques de ville, les frais de transport, les indemnités journalières liées aux arrêts de travail et les séjours hospitaliers. Le coût moyen total des soins par patient diabétique de type 2 avec suspicion de rétinopathie est évalué à 6 380 euros par an. Le scénario mis en place afin de modéliser l’impact économique potentiel d’une intervention de télémédecine était celui d’une télé-expertise avec ophtalmologue de ces patients avec suspicion de RD. Ils concluent à la possibilité d’économies notables, notamment sur le coût de la consultation avec l’ophtalmologiste (diminuée alors de 73 % en prenant en compte la valorisation du temps médical dédié à la télé-expertise) et sur celui du transport (-71 %). Au total, cela correspondrait à une économie de 8 millions d’euros, ce qui représente 9 % de la dépense totale actuelle pour cette population de patients par an. Ce système reste rentable même en comptabilisant le coût de l’entretien des installations et de la maintenance, lequel serait à hauteur de 50 % des économies réalisées (figure 1).
Figure 1. Perspectives d’optimisation du dépistage de la RD par l’IA.
Grâce aux programmes de télémédecine mis en place sur le territoire français, les ophtalmologistes sont soulagés du travail lié au dépistage de la RD et peuvent se concentrer sur le suivi et les thérapeutiques.
Actuellement, en France, 50 % de la population diabétique se fait dépister pour la RD. En optimisant ces résultats grâce à la télémédecine, il y a de fortes chances pour que le système soit saturé avant d’arriver à un taux de 100 %. Quant aux pays en voie de développement, qui seront de surcroît les plus touchés par l’augmentation du nombre de malades dans les années à venir, l’investissement financier initial nécessaire à la mise en place d’un programme de télémédecine est un facteur limitant, de même que le nombre insuffisant d’ophtalmologistes pour permettre le dépistage optimal de toute la population, en plus des soins nécessaires. Il se développe depuis quelques années des algorithmes d’IA pouvant interpréter des photographies de fond d’œil. Ils sont capables de détecter la présence ou non d’anomalies propres à la RD sur les clichés de rétinographies et donc d’orienter le patient soit vers une surveillance annuelle, soit vers le spécialiste. Cela s’effectue sans le contrôle de l’ophtalmo- logiste qui ne serait alors plus indispensable pour le dépistage.
Interprétation automatique du fond d’œil par intelligence artificielle
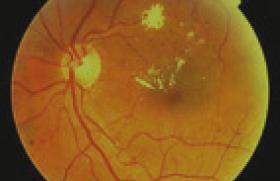
Un système de diagnostic assisté par ordinateur appliqué au dépistage de la RD doit être capable de reconnaître des structures anatomiques telles que la fovéa ou le disque optique, et de détecter les composantes nécessaires à la classification de la RD : microanévrismes, hémorragies, exsudats, nodules cotonneux, œdème maculaire, croissance anormale de vaisseaux. Il doit ensuite être en mesure de classer ces objets dans la bonne catégorie. Ainsi, la détection de la RD par un système de diagnostic assisté par ordinateur est fondée sur la reconnaissance de certaines caractéristiques afin de classer la RD en « non-référable » (absence de RD ou RDNP minime) ou en « référable » (RDNP modérée ou sévère, RDP et/ou OM), selon qu’elles nécessitent que le patient soit vu, ou non, par l’ophtalmologiste.
La création d’un algorithme de détection passe par l’utilisation de technologies d’apprentissage automatique. Elles alimentent déjà de nombreux aspects de notre société, des recherches internet au filtrage des contenus sur les réseaux sociaux, en passant par les recommandations sur les sites de commerce en ligne ; ces systèmes sont utilisés pour identifier des objets dans des images ou encore transcrire la parole en texte.
Le principe est de débuter par une phase d’entraînement, ici réalisée sur un grand ensemble d’images de fond d’œil, chacune étiquetée pour sa catégorie (son grade de sévérité). Chaque image est soumise au système qui obtient alors un score selon sa capacité à fournir la bonne réponse. L’objectif étant d’obtenir le plus haut score, le système doit modifier ses paramètres internes au fur et à mesure de ses erreurs. Désormais, grâce à la méthode d’apprentissage en profondeur nommée « deep learning », le système de reconnaissance est capable de produire des fonctionnalités non supervisées par des ingénieurs afin d’acquérir seul les bonnes représentations internes. Ainsi, il apprend automatiquement de ses erreurs pour devenir le plus sensible pour les petits détails et insensible aux grandes variations non pertinentes. Par exemple, il doit être capable de distinguer les différentes structures anatomiques quelle que soit leur position au sein de l’image ou quelle que soit la couleur de la rétine (variable selon l’origine ethnique). Une fois l’algorithme créé et entraîné sur un grand ensemble d’images, la seconde phase est de le valider sur une autre collection de fonds d’œil qu’il n’a jamais vu auparavant. Les scores de performance sont donnés en termes de sensibilité, spécificité et AUC (« area under the curve » pour aire sous la courbe). Attention, néanmoins, en ce qui concerne l’entraînement et la validation d’algorithmes de détection de la RD, car si les lésions les plus fréquentes apparaissent en quantité suffisante dans des bases de fonds d’œil, cela peut ne pas être le cas pour les lésions plus rares qui sont peu représentées, si ce n’est jamais. Or, ces lésions moins fréquentes sont généralement les plus graves et peuvent être le signe d’une RD avancée, voire d’une cécité imminente. La seule mesure de l’AUC ou des sensibilités et spécificités pour déterminer la performance d’un algorithme n’est alors pas suffisante, avec le risque de manquer une lésion rare, de forte morbi-mortalité. Il faut alors s’assurer que dans les résultats donnés, l’algorithme ait bien été entraîné sur une base de fonds d’œil fournissant suffisamment d’images de haut grade de sévé- rité. De même, en ce qui concerne la généralisation de l’utilisation de ces systèmes dans un futur plus ou moins proche, les différences ethniques quant aux caractéristiques des clichés doivent avoir été évaluées et la performance validée sur différentes populations.
Depuis 1984, où la première méthode publiée portait sur l’analyse d’angiogrammes pour la détection de microanévrismes, les algorithmes appliqués à la détection de la RD ont bien évolué. Les études les plus récentes rapportent des scores de performances entre 91,5 et 100 % pour la sensibilité et entre 95,4 et 97,8 % pour la spécificité, avec comme objectif de classer la RD en « référable » ou « non référable ». Ces résultats dépassent largement les recommandations pour un outil de dépistage, c’est-à-dire obtenir une sensibilité et une spécificité au-delà de 80 %.
Algorithmes d’IA américains et français
Le 11 avril 2018, la Food and Drug Administration (FDA) a autorisé la commercialisation de l’algorithme américain IDx-DR comme premier dispositif médical à utiliser l’IA pour le dépistage de la RD au- delà de la RDNP minime. Fin mars 2019, l’algorithme français OphtAI a obtenu le marquage « Conformité européenne » (CE) pour son utilisation dans la gradation de la RD dans le cadre de son dépistage.
L’algorithme américain IDx-DR a été examiné selon la procédure réglementaire pour les nouveaux dispositifs pour lesquels il n’existait pas de dispositif commercialisé légalement auparavant. Il a obtenu la désignation de dispositif révolutionnaire réservée aux systèmes qui permettent de traiter ou de diagnostiquer plus efficacement une maladie ou une affection potentiellement fatale ou irréversible. L’étude prospective évaluant sa performance à détecter la RDNP au-delà du stade minime rapporte une sensibilité de 87,2 % et une spécificité de 90,7 %. Les sensibilités respectives pour sa capacité à classer la RD en proliférante et à détecter l’OM sont de 97,4 % et 96,6 %. Il n’y a pas de différence significative selon l’âge, le sexe, la race, l’ethnie, le taux d’HbA1c, la présence ou non d’une cataracte, ou la localisation des lésions.
L’algorithme français OphtAI est le fruit de 14 années de recherche et est au cœur de très nombreuses publications. Ses phases d’entraînement et de validation ont été réalisées sur les photographies issues de la base OPHDIAT, divisées en deux ensembles distincts à cet effet. Pour rappel, OPHDIAT est un réseau de télémédecine développé sur Paris et la région Île-de-France, dont les images sont cen- tralisées sur un serveur sécurisé. Il s’agit d’une base de plus de 160 000 clichés de fonds d’œil de dépistage de RD recueillis depuis 2004. À titre de validation externe, l’algorithme a également été validé sur la base Messidor, utilisée pour le développement de l’algorithme américain IDx-DR. Si l’on se place à spécificité identique de 87 %, OphtAI obtient une sensibilité de 99 %, contre 96,8 % pour son homologue américain (étude préliminaire à celle citée ci-dessus qui est l’étude prospective), soit une réduction du nombre d’erreurs divisée par trois. En ce qui concerne la gradation de la sévérité de la RD, les scores de performance sont élevés avec des AUC supérieures à 0,985 pour la RDNP modérée, sévère et la RDP, et de 0,920 pour la RDNP minime. La conception de l’algorithme OphtAI s’inscrit dans le projet RetinOpTic qui a pour objectif d’augmenter les capacités de dépistage de la RD tout en réduisant la charge de travail des ophtalmologues. Une évaluation multisite de son application en population réelle va être lancée.
OMCS = œdème maculaire cliniquement significatif.
Vers une cohabitation de la télémédecine et de l’IA en France ?
Comme vu précédemment, en France, le système de dépistage grâce aux programmes de télémédecine permet la capture et le stockage centralisé de photographies de fonds d’œil avec interprétation en différé par l’ophtalmologiste. Avec l’apparition de l’IA, l’utilisation d’algorithmes de détection permettra de se soustraire aux étapes de stockage et de lecture, car l’interprétation des clichés sera réalisée dans le même temps que l’examen, avec des rapidités allant de l’ordre de la seconde à quelques minutes selon les systèmes (figure 1).
Cela permettrait de libérer l’ophtalmologiste du temps consacré à cette population. Les rétinographies seront envoyées sur un serveur qui les interprétera et en renverra le compte rendu. L’épargne de temps serait majeure sur le long terme. L’objectif est clair et s’installe dans la continuité de ce qui a commencé à se mettre en place avec la télémédecine : l’amélioration de l’accès au dépistage avec la possibilité de prise en charge de patients de plus en plus nombreux et une potentielle réponse au défi des déserts médicaux. Grâce à la mise sur le marché récente d’algorithmes d’IA, nous pouvons imaginer leur intégration au système actuel, avec un déplacement du cadre dans la stratégie du dépistage et du suivi de la RD : l’utilisation de l’IA pour son dépis- tage et l’extension de l’utilisation de la télémédecine pour les patients atteints de RDNP modérée (tableau 2).
OMCS = œdème maculaire cliniquement significatif.
Sur le plan économique, la rentabilité d’un tel système en France reste encore à évaluer. Une récente étude menée au Royaume-Uni a étudié la rentabilité économique de ces systèmes face au programme actuel réalisé par télémédecine. Le modèle utilisé a pris en compte les performances de dépistage des systèmes automatisés, l’efficacité du dépistage manuel et les probabilités de réanalyse ainsi que les taux d’aiguillage vers un ophtalmologiste. Les évaluations réalisées montrent une rentabilité du système sur plus de 20 000 patients dépistés en faveur de la lecture automatisée. En termes de chiffres, pour le système EyeArt, si un algorithme d’IA remplace entièrement le premier niveau de dépistage, une économie de plus de 100 000 dollars peut être attendue. Cette simulation peut tout à fait s’appliquer aux états ayant développé leur propre algorithme d’IA et ayant un niveau technologique tout aussi avancé, ce qui est le cas de plusieurs pays occidentaux, dont la France.
Les projets des ophtalmologistes et diabétologues français en pointe dans ce domaine
PREPS Télérétinodiab et projet Evired
Le PREPS (Programme de REcherche sur la Performance du Système de soins) Télérétinodiab est un projet en cours qui vise à évaluer le suivi par télé-expertise des patients ayant une RD modérée après réalisation de clichés de rétinographie, d’un OCT, d’une mesure du tonus oculaire par tonomètre à air pulsé, d’une mesure de l’acuité visuelle par un orthoptiste et interprétation à distance par des ophtalmologistes experts dans le domaine de la RD.
L’objectif principal du projet EviRed est de développer et valider un système expert aidant l’ophtalmologiste en améliorant la prédiction de l’évolution et la prise de décision lors du suivi de la RD. Il remplacera la classification actuelle de la rétinopathie diabétique qui fournit une précision de prédiction insuffisante. Il utilisera des dispositifs modernes d’imagerie du fond de l’œil et de l’IA pour intégrer correctement la quantité massive de données qu’ils fournissent avec d’autres données médicales du patient. Une cohorte de 5 000 patients diabétiques sera recrutée et suivie pendant une moyenne de 2 ans afin de collecter des données pour créer et valider les algorithmes. L’objectif principal sera la validation de l’outil de pronostic et d’évaluer avec quelle précision l’algorithme peut prédire la progression vers une rétinopathie sévère l’année suivante. Les principaux critères de jugement seront la sensibilité, la spécificité et l’ASC de l’algorithme pour une augmentation annuelle du risque de progression vers une forme sévère de RD.
Conclusion
▪ Les motivations à l’extension de la téléophtalmologie et à l’implantation de l’IA dans le dépistage et le suivi de la RD sont d’ordre démographique, sanitaire et économique.
▪ Environ 50 % des patients diabétiques se font dépister pour la RD aujourd’hui en France, l’utilisation plus large de la télémédecine est un moyen fiable et rentable d’améliorer l’accès au dépistage.
▪ L’extension de l’utilisation de la télémédecine pour le suivi des patients diabétiques atteints de RDNP modérée est en cours d’étude.
▪ L’interprétation automatique du fond d’œil par IA est aujourd’hui un moyen fiable de classer la RD.
▪ En France, l’algorithme OphtAI a obtenu le marquage CE pour son utilisation dans le cadre du dépistage de la RD et son évaluation prospective en population va débuter.
▪ La cohabitation de la téléophtalmologie et de l’IA est une perspective pouvant permettre de faire face à l’épidémie grandissante du nombre de patients diabétiques et aux déserts médicaux.
▪ La rentabilité économique d’un tel modèle reste encore à évaluer, mais semble prometteuse au sein d’un système déjà coûteux qui ne demande qu’à dépenser moins.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :