Publié le 31 mar 2007Lecture 8 min
Comment dépister et traiter une ostéoarthropathie diabétique ?
N. LANG-LAGUERRE, I. GOT, Hôpital Jeanne d’Arc, Dommartin-les-Toul
L’ostéoarthropathie nerveuse diabétique (OAND) est la première complication diabétologique décrite. Elle reste toutefois mal connue sur le plan de sa pathogénie, avec un retard diagnostique fréquent. Son pronostic est relativement sombre tant sur le plan fonctionnel que de la morbi-mortalité.
L'OAND est une complication dévastatrice chronique et progressive sur le plan ostéoarticulaire, avec une atteinte préférentielle des articulations du pied, même si d’autres localisations ont été décrites (genou, rachis, poignet, etc.). Elle s’inscrit dans le cadre d’une neuropathie sévère et le diabète est à l’heure actuelle la première cause d’ostéoarthropathie. Sa prévalence est évaluée entre 0,1 et 0,4 % mais peut atteindre 3 % si l’on prend en compte les formes minimes. Elle est en augmentation et probablement sous-estimée en raison de nombreuses formes non diagnostiquées (10 à 15 % de modifications radiologiques sont observées en cas d’antécédents d’ulcères neuropathiques).
L’OAND atteint préférentiellement des patients âgés de 50 à 60 ans, sans prédominance sexuelle, diabétiques depuis au moins 10 ans, avec toutefois des formes révélatrices de diabète décrites. Il s’agit dans deux tiers des cas de diabétiques de type 2. L’équilibre glycémique est le plus souvent médiocre avec une HbA1c en moyenne à 9,4 %.
Quand y penser ?
Le diagnostic est avant tout clinique et doit se faire à la phase aiguë ! À ce stade, on observe un pied d’allure inflammatoire, érythémateux, chaud, œdématié et paradoxalement peu voire non douloureux. Il peut exister à la mobilisation une perception de crépitations et une instabilité articulaire. L’installation de ce tableau inflammatoire s’avère le plus souvent brutale. Des déformations peuvent déjà être observées à ce stade et se manifestent par une proéminence du bord médian (figures 1 et 2).
La notion de facteur déclenchant n’est pas toujours retrouvée. Il peut s’agir et c’est le plus souvent le cas d’un traumatisme, d’un geste chirurgical voire d’un simple surmenage articulaire. Mais cette circonstance déclenchante est souvent oubliée par le patient qui ne la considère pas comme un traumatisme en l’absence de douleur. Cela représente près de deux tiers des cas.
À un stade plus tardif, on note une régression du caractère inflammatoire du pied, ce qui correspond à la phase de réparation osseuse avec installation des déformations et des troubles trophiques.
Figure 1. Présentation typique de pied de Charcot. A : face plantaire, à noter un début d’ulcération en regard de la proéminence du bord médian. B : face dorsale, aspect inflammatoire avec un œdème marqué du dos du pied.
Figure 2. Complication d’une poussée d’OAN, non diagnostiquée avec poursuite de la marche. Déformation typique de pied de Charcot compliqué d’ulcérations, secondairement infectés. Par ailleurs, altération du retour veineux probablement secondaire à l’importance de l’œdème. Devant cette présentation une sanction chirurgicale d’amputation a été réalisée.
Les 5 formes d’ostéoarthropathie nerveuse (OAN) selon la classification anatomique de Sanders et Fryberg
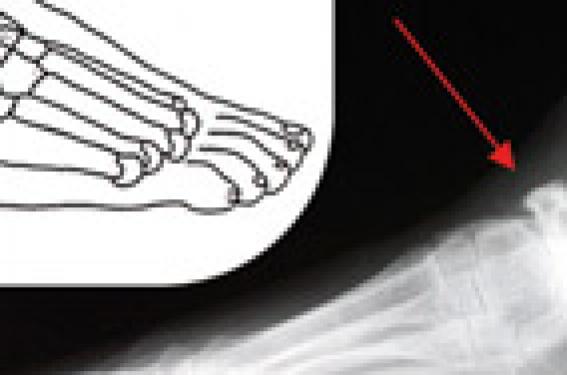
L’OAN de type 1 correspond à une atteinte des articulations méta-tarsophalangiennes ou interphalangiennes, avec l’aspect radiologique typique de « sucre d’orge sucé ». Elle représente 10 à 30 % des cas, mais sa fréquence est probablement sous-estimée en raison de nombreuses formes non diagnostiquées (diagnostic le plus souvent radiologique) (figure 3).
L’OAN de type 2 correspond à une atteinte tarso-métatarsienne ou de l’articulation de Lisfranc. Il s’agit du tableau typique de pied de Charcot (effondrement de la voûte plantaire, raccourcissement antéropostérieur, épaississement du bord interne et œdème du dos du pied). Elle représente 46 à 48 % des formes d’OAN (figure 4).
L’OAN de type 3 correspond à une atteinte du tarse, de l’articulation de Chopart. Elle représente 32 à 34 % des cas (figure 5).
L’OAN de type 4 correspond à l’atteinte de la cheville et se présente comme un tableau de fracture de cheville, mais avec une ostéolyse massive. Elle ne représente que 3 à 10 % des cas (figure 6).
L’OAN de type 5 correspond à l’atteinte du pilon postérieur impliquant le calcanéum. Il s’agit le plus souvent d’une fracture de la tubérosité postérieure du calcanéum. Elle représente moins de 2 % des cas (figure 7).
Figure 3. OAN de type 1. A : illustration anatomique, OAN type 1 ; B : illustration radiologique, OAN type 1. Aspect de sucre d’orge sucé.
Figure 4. OAN de type 2. A : illustration anatomique, OAN type 2 ; B : illustration radiologique, OAN type 2. Aspect de destruction et luxation de l’articulation de Lisfranc du pied droit.
Figure 5. OAN type 3. A : illustration anatomique, OAN type 3 ; B : illustration radiologique, OAN type 3. Aspect d’écrasement du scaphoïde tarsien.
Figure 6. OAN de type 4. A : illustration anatomique, OAN de type 4 ; B : illustration radiographique, OAN type 4. Ostéolyse massive de la cheville.
Figure 7. OAN de type 5. A : illustration anatomique de l’OAN de type 5 ; B : illustration radiologique, OAN type 5. Imagerie de type tomographie, fracture du calcanéum.
Des formes bilatérales, plus ou moins symétriques, peuvent être observées dans 9 à 25 % des cas et des formes étendues (atteinte de plus d’une localisation au même pied) dans 7 à 11 % des cas.
Et en cas de doute diagnostique ?
Les examens paracliniques ont essentiellement pour but d’éliminer les diagnostics différentiels, en particulier les causes infectieuses (ostéomyélite).
- La radiographie standard est simple d’accès, mais de sensibilité et de spécificité médiocres et avec un retard sur la clinique d’au moins 15 jours. La scintigraphie osseuse n’a pas d’intérêt. L’IRM apparaît l’examen le plus approprié, notamment en cas de doute sur une composante infectieuse ; toutefois l’accès à l’IRM n’est pas toujours facile et dans ce cas le scanner peut lui être préféré (figure 8).
- Concernant les paramètres biologiques, le dosage de la protéine C réactive (CRP) et la numération des globules blancs peuvent être discutés, leur augmentation pouvant témoigner d’un problème infectieux ; le taux de CRP peut toutefois être modérément augmenté en cas d’OAN.
- La biopsie osseuse dans certains cas peut être également discutée.
Figure 8. Aspect en IRM. A : IRM, séquence T1, profil : destruction osseuse du médio-pied associée à un œdème étendu des parties molles. B : IRM, séquence T1, coupe axiale.
Pourquoi une telle atteinte et comment ?
La pathogénie de cette complication reste complexe et implique plusieurs mécanismes :
- d’une part, l’atteinte neurologique végétative, responsable d’une dénervation sympathique avec une augmentation des flux artériels, une ouverture des shunts artérioveineux favorisant l’hyperhémie, avec au niveau osseux un remodelage accru prédominant sur l’activité ostéoclastique, responsable d’une fragilisation de la trame osseuse ;
- d’autre part, l’atteinte neurologique sensitive, responsable d’une perte de la sensibilité douloureuse, avec la répétition de microtraumatismes favorisant des destructions osseuses. Par conséquent, l’importance des dégâts osseux s’avère conditionnée par le délai entre le diagnostic et la mise en décharge, compte tenu que la poursuite de l’appui constitue en soi un traumatisme (figure 9).
Figure 9. Schéma résumant la physiopathologie de l’OAN.
Existe-t-il des facteurs de risque au développement d’une telle complication ?
On peut retenir essentiellement les facteurs de risque du développement d’une neuropathie diabétique (ancienneté du diabète, équilibre glycémique médiocre, etc.), les autres causes de neuropathie, en l’occurrence l’alcoolisme, et les causes de fragilité osseuse (ostéoporose, anorexie).
Comment traiter ?
Il n’y a pas d’attitude clairement définie en raison de la relative rareté de la pathologie et de l’absence d’études randomisées ; le traitement se limite souvent à la mise en décharge de l’articulation atteinte.
La mise en décharge
Elle consiste en une suppression de l’appui. Elle doit être totale dans un premier temps et consiste souvent, à la phase aiguë, en un repos au lit ou en fauteuil roulant pendant au moins 10 à 15 jours. Puis le système de décharge est adapté parallèlement à la régression des signes inflammatoires et fait appel à des dispositifs visant à soulager l’articulation lésée tout en permettant la reprise de la marche (bottes plâtrées ou en résine plus légères, bottes bivalves avec appui sous-rotulien, bottes avec étrier, etc.). Ces dispositifs sont à discuter avec les services de rééducation et de réadaptation. En effet, la durée de cette mise en décharge est en moyenne de 6 à 12 semaines. Le traitement est vécu comme long et contraignant et pose des problèmes d’observance thérapeutique, d’autant plus que le patient est le plus souvent asymptomatique. Idéalement, le dispositif doit permettre une immobilisation précoce, courte, avec immobilisation articulaire et une limitation de l’appui ; il doit être confortable et pouvoir être retiré la nuit (figure 10).
Par ailleurs, il faut également rester vigilant vis-à-vis du pied controlatéral qui, du fait de l’immobilisation, risque d’être hypersollicité.
Figure 10. La botte bivalve.
Il existe peu voire pas de place pour la chirurgie
Et ce, en raison du risque d’accélération du processus de destruction osseuse et d’effondrement articulaire. Les indications s’avèrent donc extrêmement restreintes et concernent uniquement la phase chronique en cas d’instabilité articulaire, d’ulcères récidivants ou de déformations. Cette chirurgie doit idéalement être pratiquée par des équipes entraînées.
L’administration de bisphosphonates
En administration unique par perfusion (pamidronate), elle peut se discuter en raison de son action sur l’activité ostéoclastique. Ce traitement a montré dans une étude qu’il permettait une amélioration plus rapide de l’œdème, de l’inconfort, de la température cutanée et des marqueurs osseux.
À la phase chronique
La reprise de l’appui devra se faire de façon progressive, avec un chaussage adapté en raison des déformations acquises et sous surveillance. L’éducation du patient s’avère également indispensable et le sensibilisera aux risques liés à son altération de sensibilité, à l’importance des soins locaux et unguéaux ainsi que d’un chaussage adapté.
Des patients à risque !
L’OAND est une pathologie évolutive et ce d’autant plus que la mise en décharge initiale s’avère insuffisante, avec un risque de nouvelles poussées, et de déformations, sources de complications pouvant conduire à l’amputation. La bilatéralisation de l’atteinte est observée dans 9 à 20 % des cas. Sur 10 ans, 47 % des patients présenteront une nouvelle poussée.
L’amputation apparaît la complication la plus sévère en raison de sa morbi-mortalité (9 à 21 % de nouvelle amputation à 1 ans, 28 à 51 % à 5 ans et mortalité de 39 à 68 % à 5 ans selon le niveau d’amputation).
Les ulcères sont observés dans 6 à 54 % à la phase aiguë avec un risque de récidive élevé de 19 à 58 % dans l’année.
Concernant la mortalité, il est observé une mortalité prématurée des patients atteints d’OAND, avec comme principales causes les sepsis et l’infarctus du myocarde.
Par ailleurs, il est fréquemment observé une altération de la qualité de vie du fait de l’altération des capacités physiques voire professionnelles du patient.
Conclusions
Un seul mot d’ordre : y penser !
Tout pied d’allure inflammatoire chez un sujet diabétique doit être considéré comme une poussée d’ostéoarthropathie et traité comme tel jusqu’à preuve du contraire.
La mise en décharge doit être précoce, ce qui permet de limiter les déformations et les complications (surtout des ulcérations qui peuvent secondairement se surinfecter). Cette décharge sera par la suite relayée par un appareillage approprié, avec remise en charge progressive avec un chaussage adapté.
Les patients porteurs d’OAND doivent être considérés comme à très haut risque, que ce soit pour leur pied ou en termes de morbi-mortalité.
Idéalement, la prise en charge de ces patients doit se faire dans le cadre d’équipes multidisciplinaires (médecins traitants, diabétologues, rééducateurs, prothésistes, etc.).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :